Rappel du cas clinique
Homme 66 ans, retraité actif — PCa initialement faible risque (D’Amico), cT1cNxMx, ISUP 1 (GG1), 2/12 positives (apex bilatéral), PSA initial 7,59 ng/mL.
Surveillance active depuis 9 ans.
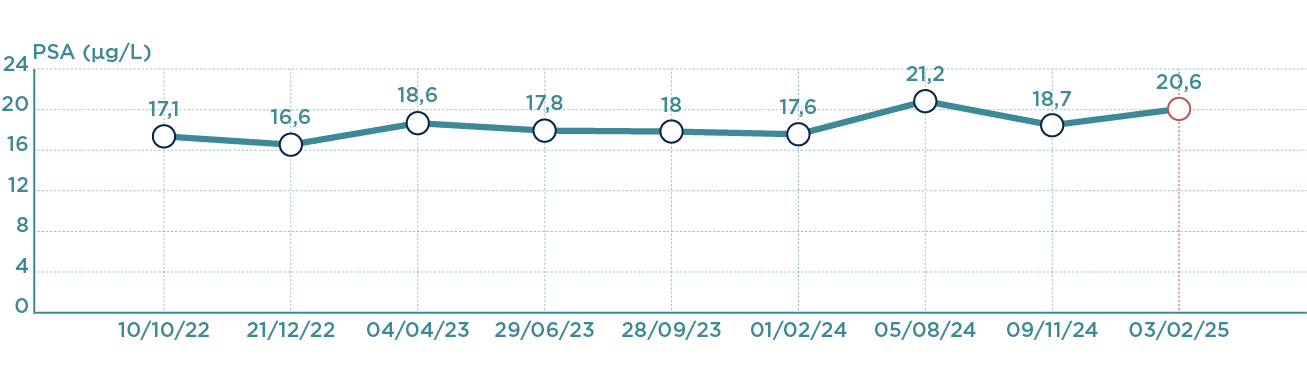
Évolution récente

Courbe d'évolution du PSA
Histologie (dernier contrôle)
- Biopsies 2020 : 1 microfoyer ADK 0,5 mm à l’apex gauche, ISUP 1 (3+3) correspondant à la lésion connue ; rien dans le quadrant controlatéral.
ATCD / état général
HTA, ostéoporose, hypercholestérolémie.
Cures de hernies inguinales bilatérales par coelioscopie avec plaques (mesh).
Pas d’antécédents familiaux (prostate/sein/ovaire).
IMC 25, OMS 0, retraité actif. Pas de tabac/alcool/allergies.
Fonctionnel
- Urinaire : dysurie, jet faible (IPSS non réalisé)
- Sexuel : rapports réguliers, peu de troubles — IIEF 22
Question du patient
« Quel traitement pensez-vous être le mieux entre la prostatectomie et la radiothérapie pour mon cas en sachant que mon principal souhait est de ne pas avoir d’incontinence ? Est-il également possible d’être traité par HIFU ? Ou encore par curiethérapie ? Mon urologue est pour l’ablation par robot. J’ai eu 2 hernies et donc 2 filets ou plaques… Les filets ne vont-ils pas gêner le chirurgien ? »
Réponse de l’expert : deuxième avis rédigé par le Pr Matthieu Durand
1) Point clé : “PSA 20” sous surveillance active = re-stadification obligatoire
Avant d’opposer prostatectomie vs radiothérapie, il faut réconcilier l’histoire (GG1 microscopique en 2020) avec la situation 2026 (PSA 20 + PIRADS 4 antérieure). Les scénarios plausibles :
- Upgrading / upstaging (lésion antérieure peu échantillonnée en 2020)
- Cause non tumorale contribuant au PSA (prostatite, rétention/obstruction, manipulations), même si l’IRM/PIRADS 4 rend l’hypothèse purement inflammatoire moins probable
Proposition pratique
- Biopsies de reclassification : ciblées IRM (antérieure TZ droite) + systématiques (transpérinéales si possible notamment pour mieux accéder à la zone antérieure)
- Documenter cinétique PSA, PSA density, et compléter LUTS (IPSS, débitmétrie, RPM)
- Le PET-PSMA est déjà fait et rassurant pour M0, utile en restadification
Les recommandations EAU insistent sur une prise en charge stratifiée par le risque et sur l’actualisation des données (imagerie/biopsies) avant décision définitive [1-3].
2) Quel est le niveau de risque aujourd’hui ?
Avec PSA > 20 ng/mL, le patient bascule a minima dans un cadre compatible avec du haut risque (selon les classifications usuelles), même si l’ISUP n’est pas encore connu sur les biopsies récentes (qui manquent) [4-5].
Conséquence pratique : les traitements “focaux” type HIFU ou une curiethérapie seule deviennent, en routine, moins pertinents tant qu’on n’a pas prouvé une maladie réellement limitée, unifocale, de grade favorable.
Le bilan d’extension par PET-TDM au PSMA constitue aujourd’hui l’examen de référence pour l’évaluation de l’extension tumorale dans le cancer de la prostate à risque intermédiaire ou élevé. Dans ce cas précis, l’absence de fixation pathologique à distance ou ganglionnaire sur le PET-PSMA confirme le caractère strictement localisé de la maladie, malgré la progression biologique marquée. Ce résultat négatif ne plaide pas en faveur d’une maladie systémique occulte et n’indique donc pas, à ce stade, l’instauration d’un traitement systémique (hormonothérapie ± intensification). Il renforce au contraire la pertinence d’une stratégie thérapeutique à visée curative locale, reposant sur un traitement local radical ou ciblé, à discuter en fonction du profil tumoral, anatomique et fonctionnel du patient [6–8].
3) Prostatectomie robot-assistée : intérêt et limites (avec focus “continence”)
Arguments en faveur
- Offre une exérèse complète + information histologique définitive (grade, extension, marges, pT)
- Option standard pour les maladies localisées de risque plus élevé, souvent dans une stratégie multimodale si besoin (RT/adjuvante ou salvage selon PSA/marges) [9-10]
- Peu d’études rapportent réellement les données en vie réelle après prise en charge par robotique qui de l’avis d’experts apportent en centre expert des résultats oncologiques et fonctionnels urinaires tout à fait pertinents y compris sur la continence précoce, en particulier chez les patients jeunes
Arguments contre (si priorité absolue = continence)
- Le risque d’incontinence postopératoire est non nul, même avec robot, nerve-sparing et rééducation : 90% de continence (0-1 pad) à 12 mois ; 8-10% d’incontinence persistante.
- Données contemporaines randomisées : l’essai PACE-A (RP vs SBRT) montre davantage de port de protections/pad use côté chirurgie, alors que la radiothérapie expose plutôt à du bowl bother (profil de toxicité différent) [11].
Question des plaques (hernies inguinales bilatérales avec mesh)
- La chirurgie radicale après cure de hernie avec mesh est généralement faisable, surtout par voie transpéritonéale robotique, mais peut être plus technique (adhérences/plan de Retzius) [18-19].
- Point important : certains travaux soulignent que le curage ganglionnaire (PLND) peut être plus difficile ou parfois à risque selon l’extension des adhérences/plaques.
Traduction clinique
- Les “filets” ne contre-indiquent pas la RARP, mais il faut que l’intervention soit réalisée dans une équipe habituée à ces situations, et anticiper l’enjeu PLND si indiqué.
4) Radiothérapie : option très cohérente si la continence est la priorité, mais…
Arguments en faveur
- Excellent contrôle tumoral en localisé, avec un profil fonctionnel souvent plus favorable sur la continence que la chirurgie [12-13], au prix d’un risque digestif/rectal variable selon techniques et dose, et de complications urinaires de troubles de la vidange à anticiper (cf. point de vigilance).
- Pour les formes à risque élevé, la radiothérapie est en général associée à une hormonothérapie (HT ADT) (durée selon stratification), et parfois à une escalade de dose (boost).
Points de vigilance importants
- Le patient a déjà des LUTS obstructifs (dysurie/jet faible) : RT (et surtout boost endoprostatique) peut majorer le syndrome irritatif/obstructif. D’où l’intérêt d’un IPSS, d’une évaluation uroflow/RPM (débimétrie), de réaliser également une cystoscopie diagnostique. Il sera prudent d’envisager un potentiel geste de désobstruction préalable à la radiothérapie ou a minima d’informer le patient d’un risque de geste secondaire s’il n’avait pas lieu avant.
- Le patient exprime une attente forte en matière de préservation de la fonction urinaire, mais rapporte également des rapports sexuels réguliers sans trouble érectile significatif.
Dans l’hypothèse d’un traitement par radiothérapie externe, celui-ci devrait très probablement être associé à une hormonothérapie de privation androgénique (ADT), compte tenu du niveau de risque actuel, pour une durée minimale d’environ 18 mois.
Une telle stratégie entraînerait quasi systématiquement une chute rapide et marquée de la libido, avec un retentissement fonctionnel et psychosexuel significatif.
Au regard du profil du patient et de son attention particulière portée à la qualité de vie, cet impact doit être clairement anticipé, expliqué et intégré à la discussion décisionnelle, car il est susceptible d’être difficilement accepté.
5) HIFU / focal therapy : à ce stade, pas l’option “standard”
Pourquoi ?
- PSA 20 + lésion PIRADS 4 antérieure + absence de biopsies récentes concordantes = risque élevé de lésions multifocales / grade sous-estimé.
- Les recommandations actuelles tendent à positionner la thérapie focale au cas par cas, idéalement en essai ou registre prospectif, plutôt que comme standard de soin [14-15].
- Les biopsies initiales mettaient en évidence des lésions bilatérales de l’apex, ce qui limite d’emblée la pertinence d’une approche focale strictement zonale. Une telle stratégie imposerait en pratique un traitement des deux apex, exposant à un sur-risque d’effets thermiques, notamment de fistule urétrale ou rectale dans cette région anatomiquement sensible.
- Dans ce contexte, une thérapie focale ne paraît pas recommandée.
6) Curiethérapie : plutôt comme “boost” chez les haut-risques (si anatomie/urinaire compatibles)
Chez les patients à risque intermédiaire/haut risque sélectionnés, un boost par curiethérapie LDR après EBRT a montré un gain de contrôle biologique, au prix d’une toxicité GU plus importante [16-17].
Traduction pour ce cas
Possible si re-biopsies confirment un profil compatible et si l’état urinaire le permet (IPSS/RPM acceptables). À discuter en RCP avec radiothérapeute curiethérapeute, surtout vu les LUTS.
Conclusion pratique (ce que je répondrais au patient)
- Re-biopsies ciblées + systématiques (lésion antérieure) indispensables avant toute décision.
- Si confirmation d’un risque au moins intermédiaire défavorable / haut risque :
- Prostatectomie robotique = option valide, avec toutefois continence moins “garantie” (cf 10% incontinence résiduelle) avec une attention au contexte mesh surtout pour le PLND, préférer un centre à haut volume de voie d’abord robotique
- RT + ADT = option solide également et souvent favorable si le seul objectif était = minimiser le risque d’incontinence… mais il ne faut pas oublier l’impact sur la libido qui sera à zéro pendant au moins 18 mois, à bien expliquer au patient le cas échéant
- Curiethérapie : plutôt en boost (pas forcément seule), en pesant le risque d’aggravation des LUTS.
- HIFU : inenvisageable car on sort du champ d’une maladie réellement localisée, unifocale, de grade favorable, et s’exposerait à un risque de sous-traitement et de sur-toxicité à l’apex.
Le Pr Matthieu Durand est professeur d’urologie au CHU de Nice, spécialisé dans la prise en charge des cancers urologiques, la chirurgie mini-invasive et robot-assistée, ainsi que les stratégies de traitement focal et personnalisé du cancer de la prostate. Il est particulièrement impliqué dans les démarches de deuxième avis médical pour des situations cliniques complexes.
Vous souhaitez soumettre un cas clinique ?
Écrivez-nous à redaction@planetemed.fr