
© Midjourney X What's up Doc
Le 12 mai 2025, Donald Trump annonce un décret pour faire baisser le prix des médicaments aux États-Unis, accusant les autres pays de profiter de prix trop avantageux. Le 4 août, il adresse un ultimatum en ce sens à 17 grandes compagnies pharmaceutiques.
Cela fait craindre, en France et en Europe, une hausse du prix des médicaments, notamment les nouvelles molécules qui traitent des besoins thérapeutiques non pourvus. Le marché pharmaceutique des États-Unis étant le plus grand au monde, une baisse de prix dans la première économie mondiale entraînera symétriquement une hausse du prix dans les autres pays.
Aux États-Unis, la négociation des prix a surtout lieu entre laboratoires et assureurs privés, avec une intervention étatique limitée, aboutissant à des prix particulièrement élevés. En Europe au contraire, les prix sont généralement plus bas, car négociés par le payeur public, avec un fort pouvoir étatique.
Or, l'administration Trump souhaite que les États-Unis bénéficient systématiquement du prix le plus bas parmi les prix constatés dans les autres pays. Cela ne laisse que deux choix aux laboratoires:
- baisser le niveau des prix aux États-Unis au niveau des prix les plus bas, notamment dans l’Union européenne (UE), les industriels du médicament supportant alors une lourde perte de revenu à l'échelle globale, obérant leur capacité à investir dans l'innovation ;
- augmenter le niveau de prix des médicaments dans les pays de l’UE et ailleurs dans le monde en les faisant tendre vers les prix américains, afin de préserver leurs marges mondiales et de limiter la baisse de leurs revenus aux États-Unis.
Au total, les pays bénéficiant actuellement des remises les plus fortes seront les plus atteints par les hausses éventuelles, et le prix global de l’innovation thérapeutique augmentera: un risque pour son accessibilité.
Cette actualité met en lumière les modèles de santé du monde, entre financement par les assurances publiques, comme en France, et par les assurances privées, comme aux États-Unis. Dès lors, de quels leviers la France dispose-t-elle face à une hausse du prix des médicaments innovants ? Qu’en est-il tout particulièrement de ceux luttant contre le cancer (oncologie) ?
Prix bas du médicament en France
La France bénéficie d’une négociation médico-économique efficace du prix du médicament. Celui-ci y est donc bien plus bas qu’outre-Atlantique, ce qui expose fortement notre pays à une éventuelle hausse des prix. Il y a une raison historique : la France représente un fort volume de vente de médicaments en Europe, solvable par une assurance obligatoire publique. De facto, le débouché est garanti pour les industriels, un argument pour négocier des prix plus faibles.
La France dispose d’un environnement réglementaire contraignant sur les prix. Les prix bas dans notre pays permettent que les restes à charge pour les ménages soient très contenus, se situant parmi les plus faibles d’Europe.
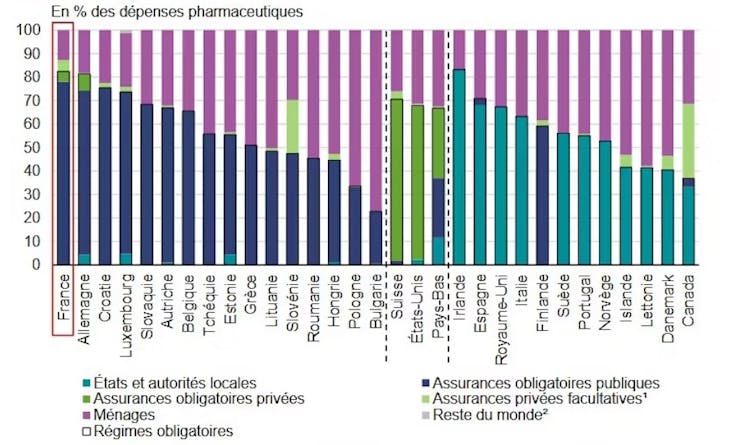
Répartition des dépenses pharmaceutiques selon le financeur. Direction de la recherche, des études, de l’évaluation et des statistiques
Cependant, la France fait face à une contrainte budgétaire croissante, illustrée par les 5 milliards d’euros d’économie prévus dans les comptes sociaux 2026. Ses marges de manœuvre face à une hausse du prix de l’innovation seraient donc particulièrement réduites.
Accessibilité des médicaments
La France présente une accessibilité plus faible à l’innovation pharmaceutique que ses voisins européens 63 % des nouveaux médicaments sont disponibles en France, contre 88 % en Allemagne. Par exemple, en oncologie (diagnostic et traitement des cancers), la France se positionne au 6ᵉ rang en terme de disponibilité en Europe en 2020.
Pour expliquer ce défaut d’accessibilité, les industriels pointent les carences du marché français du médicament. Parmi les freins à l’accessibilité, le syndicat des industries du médicament (LEEM) souligne le prix trop bas des médicaments en France, qui ne serait pas attractif par rapport aux pays comparables européens.
Ce manque d'attractivité ne se limite pas au prix, et serait renforcé par des délais d'accès trop longs au marché français, notamment par rapport à l’Allemagne. Ce contexte n’incite pas les industriels à prioriser le marché français pour leurs lancements.
La procédure d’accès précoce permet de nuancer grandement cet argument du délai d’accès.
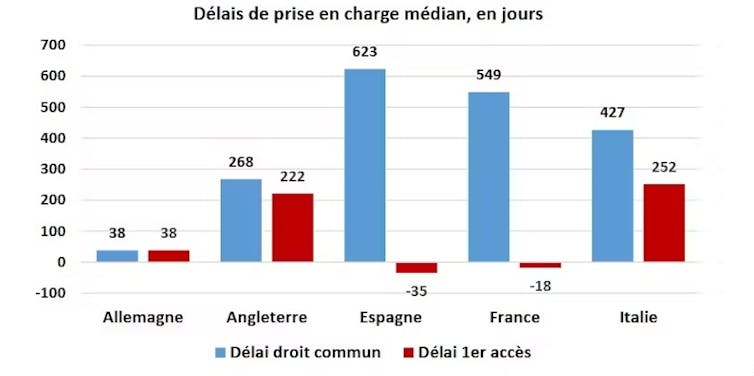
En France, lors d’une procédure d’accès précoce dérogatoire, le médicament arrive sur le marché 18 jours avant son autorisation de mise sur le marché (AMM), contre 549 jours après l’AMM pour la procédure normale. Assurance maladie en France
Grâce à cette procédure dérogatoire, un médicament présumé innovant, répondant à un besoin médical majeur et grave, est remboursé sur le marché sans devoir attendre la fin de la procédure d’autorisation de mise sur le marché (AMM).
Cela a permis de réduire drastiquement ces délais d’accès pour plus de 120 000 patients en France, concernant une centaine de molécules coûteuses et innovantes, surtout en oncologie.
Motifs d’inquiétude
Une autre préoccupation, solidariste, reflète plutôt les attentes du payeur public. Elle est illustrée par l’avis 135 du Comité consultatif national d’éthique (CCNE) de 2021. Ce dernier s’inquiète de la pérennité de notre modèle social.
« Les prix très élevés de certains traitements innovants pourraient compromettre l’équilibre financier des systèmes de soins dans leur fonctionnement actuel. »
Depuis cet avis, les motifs d’inquiétude ont crû parallèlement à la hausse des prix de l’innovation. Désormais le médicament le plus cher du monde, le Libmeldy (traitement de la leucodystrophie métachromatique), atteint, pour l'ensemble du traitement, 2,5 millions d’euros en Europe et aux États-Unis environ 4,25 millions de dollars.
Contrats de partage du risque
Parmi les nombreux dispositifs qui s’offrent à nous, certains permettent de maîtriser le prix et l’accès au marché, très en amont dans la négociation, tout en soutenant les innovations performantes.
C’est le cas des contrats de partage du risque, dit risk sharing agreement. Ils sont documentés depuis une quinzaine d’années et inscrits, par exemple, dans l’article 54 du projet de loi de financement de la Sécurité sociale (PLFSS) en 2023 pour les médicaments de thérapie innovante (MTI). Ces accords entre un laboratoire pharmaceutique et le payeur public visent à limiter les conséquences financières des nouveaux traitements.
Ces contrats sont encore peu exploités en France. Ils constituent un vivier d’efficience que les politiques publiques pourraient utiliser en cas d’inflation du prix de l’innovation thérapeutique, sur fond de guerre tarifaire venant des États-Unis de Donald Trump.
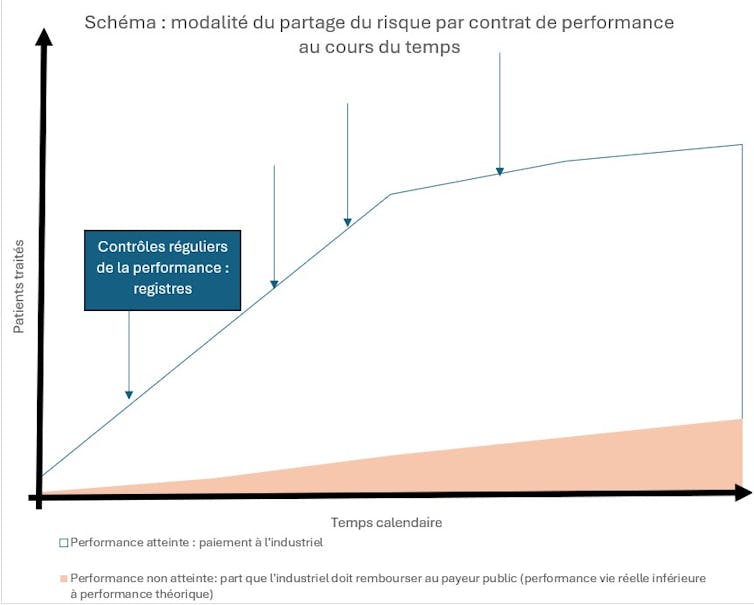
Fonctionnement schématique des contrats de partage de risque. Schéma de l’auteur, d’après Launois et Ethgen (2013), Fourni par l'auteur
On distingue :
- Des accords purement financiers (financial based agreements), les plus répandus. Ils plafonnent les dépenses, avec des seuils de volumes (accord prix-volume) au-delà desquels l’industriel réduit son prix afin de stabiliser l’enveloppe budgétaire. En échange, le payeur public garantit des volumes et un meilleur accès au marché.
- Des accords de performance (performance based risk sharing agreements) qui indexent le paiement sur la performance réelle du médicament, plutôt que sur les seuls résultats des essais cliniques. Ils portent sur des critères d’efficience clinique, avec des clauses de remboursement total ou partiel par l’industriel en cas de résultats insuffisants en vie réelle. Ces contrats sont très adaptés aux médicaments ayant une population cible restreinte (afin de pouvoir suivre correctement la performance en vie réelle), ou pour lesquels l’incertitude sur l’efficacité en vie réelle est élevée lors de la commercialisation.
L’exemple italien en oncologie
L’Italie est souvent considérée comme le pays européen le plus avancé dans les accords de partage de risque, en particulier en oncologie. En 2017, le montant économisé via ces contrats y était estimé à près d’un demi-milliard d’euros (35 millions sur les seuls contrats de performance). En oncologie, les molécules couvertes par ce dispositif auraient vu leur délai d’accès au marché diminuer de 256 jours.
Ce déploiement en Italie a été accompagné tôt par un système pointu de collecte et d’évaluation des données de performance en vie réelle, géré par l’Agence italienne de santé publique (AIFA). En 2016, elle disposait déjà de 172 registres de données de vie réelle portant sur plus de 300 contrats de partage de risque, concernant environ 900 000 patients.
Le coût supplémentaire de ce suivi était estimé dans une fourchette de 30 0000 à 60 000 euros par médicament et par an la première année, dégressif ensuite. La question du partage de ce coût entre le payeur public et l’industriel doit également être prise en compte.
Une telle logique de collecte des données de performance en vie réelle a fait défaut en France. Cela explique en partie notre retard et le faible nombre de contrats de performance – une quinzaine en dix ans, selon l’économiste de la santé Gérard de Pouvourville.
Aujourd’hui, reste le défi de développer ces contrats sans que le suivi de la performance accapare des ressources soignantes dans un contexte de pénurie de temps et de moyens médicaux.
Solidarité mise à rude épreuve
Le problème de l’équilibre entre le soutien à l’innovation, son accessibilité et la soutenabilité du système de santé n’est pas seulement français. C’est un enjeu si important qu’il a été intégré à la Stratégie pharmaceutique pour l’Europe en 2020.
Le projet européen Hi-Prix y cherche une réponse, avec la création du Pay for Innovation Observatory, qui recense en ligne l’ensemble des dispositifs de financement de l’innovation.
Face à l’inflation du prix des médicaments innovants, sans commune mesure avec leur soutenabilité pour les systèmes de santé, émerge aussi un débat éthique, que ne pourront résoudre les seules prédictions économiques.
Si le prix de l’innovation, notamment pour les maladies orphelines ou rares, continue d’augmenter et si, en même temps, des avancées diagnostiques, notamment les techniques géniques, lèvent l’incertitude sur les aléas et les états de santé futurs des individus, il existe un risque de fragiliser le consentement à payer, base du contrat tacite de solidarité assurantielle dans nos sociétés.![]()













