The Conversation : Le variant Omicron, devenu majoritaire au niveau mondial, continue à se répandre et à évoluer. Mais ses nouveaux avatars sont désormais désignés comme BA.1, BA.2, puis BA.4 et BA.5… Comment s’y retrouver ?
Samuel Alizon : Effectivement, il y a de quoi se perdre dans ce foisonnement de nomenclatures ! Les lettres grecques ont été introduites par l’Organisation mondiale de la santé (OMS) en 2021 avec le variant Alpha. C’est probablement la pire des classifications, car elle a été élaborée sans prendre en compte la biologie de l’évolution. Celles de Pango ou Nextclade sont bien plus adaptées. D’ailleurs, l’OMS semble avoir arrêté ses mises à jour et regroupe sous le terme générique d’Omicron tous les variants de type BA.
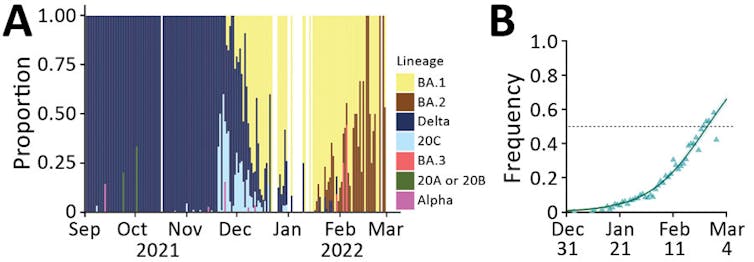
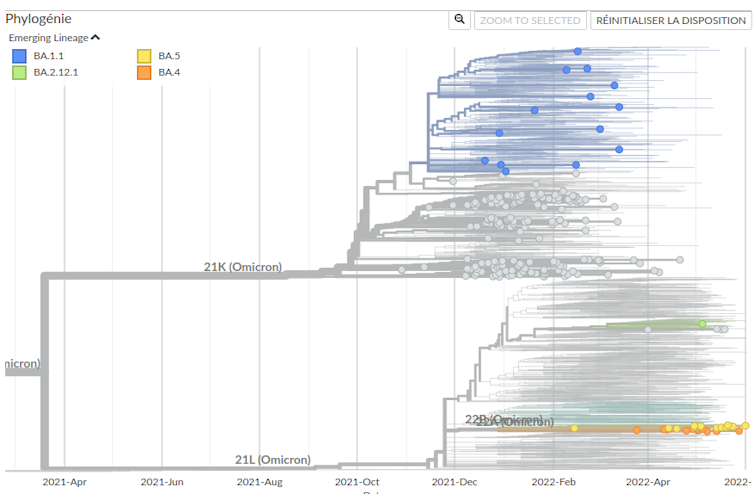
Nous avons modélisé la circulation des lignées de variants en France dans un travail récent (voir ci-dessus) et la première vague Omicron causée par la lignée BA.1 ressort dès fin 2021. Celle-ci a rapidement été supplantée par lignée BA.2, qui a causé une seconde vague hospitalière en avril 2022. Maintenant ce sont les lignées BA.4 et BA.5 qui prennent le pas.
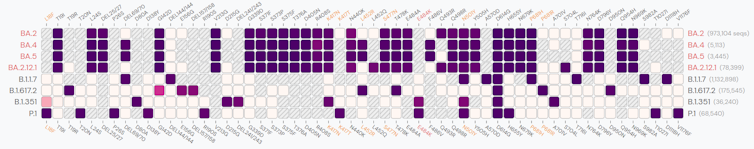
Mircea T. Sofonea : Ces lignées ont été identifiées courant mai, mais elles auraient vraisemblablement émergé au cours du mois de décembre 2021 en Afrique du Sud, potentiellement à partir de BA.2, la lignée majoritaire en France depuis mars 2022. Tandis que le variant BA.2 était aussi différent de BA.1 que le variant Delta l’était du variant Alpha, la divergence évolutive entre BA.4 et BA.5 est plus limitée. Toutefois, même si le nombre de nouvelles mutations est limité, certaines interpellent. Ainsi, la mutation 452R de la protéine Spike est connue pour conférer une plus grande affinité avec le récepteur humain ACE2, utilisé par le virus pour pénétrer dans nos cellules. La mutation 486V, toujours dans la protéine Spike, confère quant à elle une assez grande capacité d’évasion immunitaire au virus. Néanmoins, il convient d’être prudent avec le raisonnement par analogie appliqué aux mutations isolées. Car l’effet de ces dernières n’est ni absolu ni cumulatif ; il dépend de l’ensemble du génotype, avec de potentiels phénomènes synergiques et antagonistes, y compris pour des positions éloignées sur le génome (on parle d’épistasie).
Ces mutations sont-elles des innovations de ces variants, ou BA.4 et BA.5 « piochent-ils » dans toutes les possibilités qui ont été testées par leurs prédécesseurs – Delta, Gamma, Beta, Alpha ?
MTS. : Rappelons qu’Omicron n’est pas le descendant de précédents variants, mais un cousin éloigné, et que les virus ne mutent pas de façon volontaire ni dirigée. Les mutations détectées dans le génome d’une nouvelle lignée sont apparues par hasard. La mutation 452R n’était pas présente dans les lignées BA.1 ou BA.2, mais on la trouvait bien chez le variant Delta. C’est d’ailleurs une des trois mutations recherchées dans les tests de criblages actuellement réalisés sur tous les tests PCR positifs en France. La mutation 486V n’est associée à aucune des lignées circulant au sein de notre espèce, mais des expériences dites de deep mutational scanning, qui consistent à générer des protéines avec des mutations, l’avaient identifiée comme étant potentiellement impliquée dans l’évasion à l’immunité.
SA. : Concernant les différences entre variants, deux mécanismes génétiques sont impliqués : les mutations et la recombinaison. Cette dernière permet un brassage de portions entières du génome lorsque deux virus de lignées différentes « co-infectent » un même hôte. Au niveau biologique, plusieurs hypothèses coexistent pour expliquer l’émergence de variants : la circulation accrue dans une population, l’implication d’un réservoir animal ou les infections chroniques chez des personnes immunodéprimées. En effet, ces dernières ne parviennent pas à éliminer le virus, qui cause donc des infections plus longues et plus létales. Une prépublication (donc à prendre avec précautions, car non encore relue par les pairs) d’une équipe de New York décrit ainsi l’évolution intra-patient d’un virus BA.1 avec l’accumulation de mutations clés et, surtout, sa transmission à au moins cinq autres personnes. Dans le cas de BA.4 ou BA.5, comme leurs différences avec BA.2 sont assez limitées, il pourrait ne s’agir que de mutations fixées au fur et à mesure de la circulation du virus.
Pourquoi BA.4 et BA.5 se propagent-ils maintenant en France ?
SA : On peut facilement estimer un avantage de croissance d’une lignée par rapport à une autre dans une population. Selon notre équipe, celui de BA.5 est de l’ordre de 9 % en France par rapport à BA.2. En revanche, il est compliqué de savoir d’où provient cet avantage. BA.5 se propage-t-il plus, car il est plus contagieux ? Ou bien parce qu’il échappe mieux à l’immunité ? Une prépublication par une équipe japonaise et une publication par une équipe chinoise mettent en avant le rôle de l’échappement immunitaire, notamment via la mutation 486V. Quelle que soit l’origine de cet avantage, cela peut contribuer à un rebond épidémique en France.
MTS : Un second mécanisme est aussi à l’œuvre dans l’Hexagone : l’immunité anti-SARS-CoV-2 – essentiellement hybride, c’est-à-dire à la fois post-vaccinale et post-infectieuse – décline avec le temps depuis le dernier événement immunogène (qu’il s’agisse d’une infection ou de la vaccination). Si la protection conférée par une infection Omicron ou une 3e dose de vaccin reste notable après cinq mois vis-à-vis d’une forme grave, elle est en revanche très diminuée vis-à-vis d’une infection quelconque. La susceptibilité de la population au virus (c’est-à-dire le pendant de l’immunité collective), se reconstitue donc avec le temps, ouvrant à terme la possibilité d’une reprise épidémique. En résumé, BA.4 et BA.5 se propagent à la faveur du vieillissement de notre immunité, et le font plus rapidement que BA.2, car ils bénéficient d’un double avantage de contagiosité et d’échappement immunitaire. BA.4 et BA.5 induisent donc une vague plus tôt que BA.2 ne l’aurait fait.
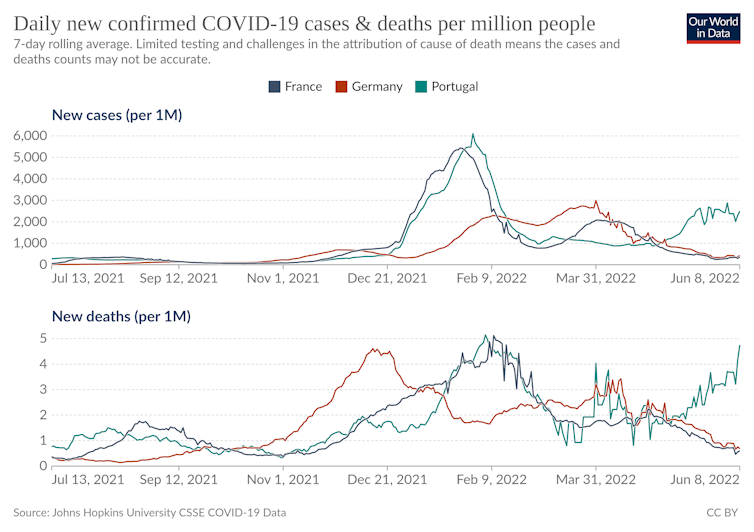
La situation au Portugal a pu inquiéter. Mais peut-on tirer des enseignements des tendances observées dans les autres pays ?
MTS : Je suis réservé sur les comparaisons interpays : elles sont de plus en plus délicates, car la circulation courante dépend, outre des mesures sanitaires en place, de l’historique épidémiologique et immunologique, de plus en plus différencié selon les pays. Au niveau de la France, il est même toujours difficile de comparer quantitativement le relâchement des mesures contribuant à la reprise, et le contexte estival qui la limite, avec des jours plus longs et plus chauds favorisant les interactions sociales en milieu aéré.
SA : Le Portugal est un des pays européens où la vague BA.4/BA.5 est la plus avancée et s’accompagne d’une hausse des hospitalisations. Il est compliqué de savoir pourquoi elle y a débuté si précocement, mais, comme pour tous les débuts d’épidémies, le rôle d’événements aléatoires du type « super-propagation » y est probablement pour beaucoup. Au niveau mondial, en Afrique du Sud, la vague BA.4/BA.5 semble sur le déclin. Aux États-Unis, en revanche, BA.2 a d’abord été remplacé par la lignée BA.2.12, mais celle-ci semble en voie de remplacement par BA.5.
Peut-on anticiper les conséquences de ces remplacements entre variants sur les futurs pics épidémiques ?
SA : En 2021, en France, un nouveau variant remplaçait les anciens, car il était plus contagieux. Depuis décembre 2021, c’est plutôt l’évasion immunitaire qui mène le bal. Ceci rend la modélisation de scénarios délicate. Les modèles de notre équipe, comme de ceux de l’Institut Pasteur ou de l’Institut Pierre Louis d’Epidémiologie et de Santé publique tenaient déjà compte de la couverture vaccinale dans la population et du pourcentage de personnes ayant eu une infection naturelle. En revanche, inclure le temps écoulé depuis la dernière vaccination ou infection naturelle est un défi, car, après deux ans de pandémie, deux campagnes vaccinales et une énorme vague BA.1, tout le monde a désormais une immunité différente !
MTS : Nous avons développé des outils pour prendre en compte cette hétérogénéité de l’immunité dans les populations. Vu nos contraintes, nous nous focalisons pour le moment sur le temps long, mais, en théorie, il devrait être possible d’utiliser ce cadre pour explorer des scénarios prospectifs à court terme. Pour le moment, difficile de dire quelle sera l’ampleur exacte de la nouvelle vague épidémique qui débute. Cette vague, au sens génétique ou virologique, est déjà bien avancée et BA.5 deviendra majoritaire vraisemblablement d’ici le 20 juin. Si on peut compter sur l’été pour diminuer l’incidence par rapport à l’hiver, il n’empêchera pas, à lui seul, une vague de contamination. Pour mémoire, un des pics de circulation en France demeure août 2020, et la 4e vague (de Delta) avait connu son pic en juillet 2021.
![]()
Samuel Alizon, Directeur de Recherche au CNRS, Institut de recherche pour le développement (IRD) et Mircea T. Sofonea, Maître de conférences en épidémiologie et évolution des maladies infectieuses, laboratoire MIVEGEC, Université de Montpellier
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.